常见的细胞污染分为以下几类∶
细胞培养中常见的生物污染类型有好几种,分别是细菌污染、支原体污染、黑胶虫污染、真菌污染、以及细胞交叉污染。他们在细胞培养中污染的特点如下:
一:细菌污染
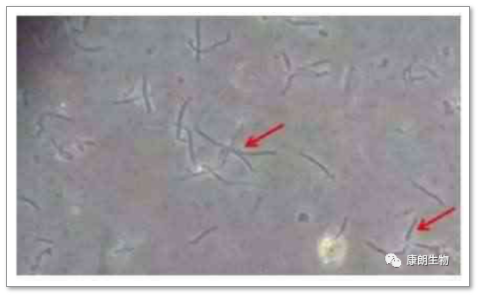
细菌污染:细菌是一种原核细胞微生物,其大小以微米(μm)计。常见的污染细菌有革兰氏阴性菌和大肠杆菌、假单胞菌等,革兰氏阴性菌中白色葡萄球菌等比较常见。
一旦发生细菌污染较易发现,多数情况下培养液短期内颜色变黄,表明有大量酸性物质产生,出现明显混浊现象;有时静置的培养液液体初看不混浊,但稍加振荡,就有很多混浊物漂起。倒置显微镜下观察,可见培养液中有大量圆球状颗粒漂浮。必要时可取少量培养液涂片染色检查以证实细菌种类;有的培养液改变不明显而又疑有污染,可取出少量培养液用普通肉汤接种或用未加双抗药物的培养液接种,也可取10ml细胞悬液以100rpm离心5min,沉淀中加入无抗生素的培养液2ml,置于37℃培养,24h可得结果。污染后细胞发生病理改变,胞内颗粒增多、增粗,最后变圆脱落死亡,造成试验失败和细胞株(系)丢失。
看到这种,别犹豫了你的细胞被污染了,那么怎么办呢,基本原则立马扔掉,别扩大污染,如果你的细胞真的十分宝贵,先用带有双抗的PBS反复冲洗几遍,然后再培养液中加入硫酸庆大霉素、新霉素(50ug/ml)等,培养3天后换成带有双抗的培养液培养。
二.支原体污染
特征:最小的微生物,无法通过光学显微镜看见,但可通过电镜观察到。感染支原体的细胞,在某一时间点碎片突然增多,随着传代,细胞状态显著变差。支原体污染可通过气溶胶传播,影响同一细胞房其他细胞。
鉴定方法:PCR法、显色法、荧光染色法等。
处理方法:若细胞状态尚可,添加支原体抑制剂培养2-3代可转阴;若细胞状态很差,建议消杀后丢弃。
三、黑胶虫污染
特征:无明确定义,镜下无法直接观察到。主要表现为细胞状态差,黑点和碎片多,布朗运动。通过检测发现主要为支原体污染,部分为未知的增殖不明显的微生物污染。
处理方式:若细胞状态尚可,添加黑胶虫/支原体抑制剂培养2-3代可转阴;若细胞状态很差,建议消杀后丢弃。
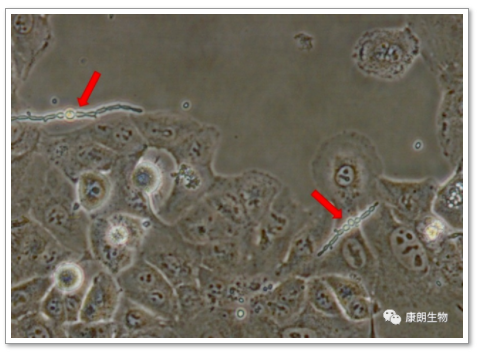
四、真菌污染
特征:呈链球状或丝状。常形成肉眼可见的菌落,培养基颜色无变化或变紫,仅对局部细胞影响较大,其他地方生长正常。会形成孢子,容易污染其他细胞。
处理方法:真菌污染较难根除,不建议保留,建议消杀后丢弃。
五、细胞交叉污染
特征:即不同的细胞混杂在一起
鉴定方法:
同种属:STR鉴定,多等位基因数大于3个。
(需考虑本身的遗传背景,如EA.hy 926为融合细胞,本身就包含两套遗传信息)
不同种属:PCR法,对种属特异性基因进行扩增,不同种属产物大小不同。
处理方法:建议重新引种。

六、细胞污染的处理
应对细胞污染的对策是预防!预防!再预防!养细胞要勤快,平时所用到的耗材、器皿等要及时高压灭菌,灭菌后超过一周未使用也应重新灭菌。配制的完全培养基、胰酶、PBS等在一周内用完。同时,也应每天查看一下细胞状态。在细胞房内应尽量少地走动,尽量少地说话,若咳嗽或喷嚏时务必背向超净台。
细胞污染后处理方式是丢弃。当个别细胞十分珍贵无法丢弃时可尽力“急救”一下。
那么如何急救呢?
1,判断污染源。一旦发现细胞有污染的迹象或已污染,立即判断可能的污染源︰有无操作不当?培养基、胰酶、PBS等颜色、澄清度是否正常?
2,及时处理。若确定现有的培养基、胰酶、PBS可用,则继续使用;若无法确定则新配完全培养基、PBS、胰酶,原有的液体在确定是否污染后再做处理。
现以贴壁细胞为例向大家介绍下细菌污染时如何“急救”∶
1),立即弃去培养容器内的培养基,以PBS润洗2~3次,加入胰酶处理至细胞形态略有改变但未脱离容器时弃去胰酶,加入PBS轻轻润洗1遍;
2),加入20×双抗,浸泡细胞3~5min,弃去双抗;
3),加入新鲜的完全培养基(含10×双抗)培养12 h;
4),12 h弃去培养基以PBS润洗2~3遍后加入完全培养基(含10×双抗);
5),传代时以较小转速离心(如平时以1000 r/min离心,则可降为800~900r/min离心),仍以含10×双抗的培养基培养;
6),若第二代后镜下找不到细菌,则第三代起可正常培养。正常培养48 h后无反弹则可认为污染已清除。
若为霉菌污染,在以PBS润洗2~3遍后换液,无需加入高浓度双抗。培养48 h后污染未再次出现即可。
若为真菌污染,在PBS润洗、换液后可加入两性霉素B(两性霉素B有细胞毒性,不推荐使用),也可加入300 ug/mL氟康唑培养,污染控制后改用150 ug/mL培养2~3代。
若怀疑支原体污染,则可进行PCR检测或直接使用支原体清除试剂(如∶某恒生物)。也可购买环丙沙星注射液,于超净台内打开直接添加到培养基中,以20 ug/mL浓度2代后改用10 ug/mL浓度持续培养约2周。
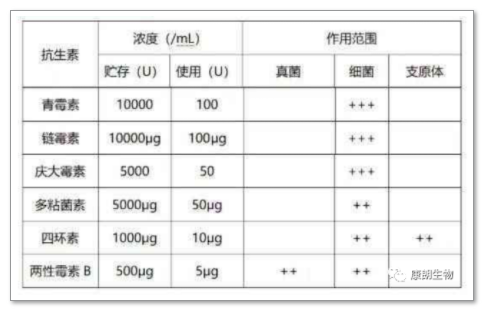
附∶常用抗生素剂量和抗菌范围
以上内容来源网络
 在线客服1号
在线客服1号




